1983 yilinda Galla ve Monagnier AIDS etkeni HIV(Human immunodeficiency virüs)’yi tanimladilar. 1986 yilinda Bati Afrika’da HIV2 adinda bu virüsün yeni bir tipi bulundu. AIDS’in kelime anlami: Edinilmis bagisiklik yetmezligi sendromudur. AIDS’e neden olan HIV retrovirideae grubunun Lentivirineae ailesinde yer alir. HIV disindaki lentiviruslar diger canlilari enfekte ederler. FIV(feline immunodeficiency virüs)kedileri, SIV(simian immunodeficiency virüs) insan olmayan primatlari enfekte eder.
Bilinen ilk vaka ABD’de 1969’da bagisiklik yetmezliginden ölen bir erkek çocuktu. Saklanmis olan dokularinda HIV’ye karsi üretilen antikorlar bulunmustur. 1969’dan önce depolanan kan örneklerinde bu antikorlarin bulunamamasi HIV’nin yeni bir virüs oldugunu düsündürüyor.
Dünya Saglik Örgütü (WHO)’nün yürüttügü program sonucunda elde ettigi verilere göre 1998 yilinin baslangicinda dünyada 30 milyon kisi HIV’yi tasiyor ve bu tarihe kadar 11,7 milyon kisi AIDS hastaligindan dolayi hayatini kaybetmistir. Günde ortalama 16.000 kisi HIV ile enfekte oluyor. Yayilma oranlari Asya’da, Güney Afrika’da, ve Türkiye’nin de içinde bulundugu Dogu Avrupa’da hizla artiyor. 2000 yili itibariyle dünyada 100 milyondan fazla HIV tasiyan birey bulundugu tahmin ediliyor. Ülkemize gelince Saglik Bakanliginin 30 Nisan 1997 tarihli verilerine göre toplam HIV tasiyan birey sayisinin 671 oldugu görülüyor. Türkiye’deki AIDS hastasi olan birey sayisi tahmin edilirken Saglik Bakanliginin kayit tutmada ne kadar saglikli oldugu ve kayitlara geçmeyen birçok hastanin oldugu göz önüne alinmalidir.
HIV’NIN YAPISI
HIV pozitif polariteli birbirinin ayni 2RNA molekülü içeren, kapsid yapisi ikozahedral olan zarfli partiküllerdir. virüsün çapi1/10.000mm dir. Bünyesinde 3 enzim barindirir. Bunlar: Revers Transkriptaz, integraz ve proteazdir. Zarfi konakçidan alinmis lipidlerin yaninda gp41 glikoproteinleri ve gp120 glikoproteinlerini içeren peplomerler olusturuyor. Kapsid p17 ve p24 proteinlerinden olusuyor. Kapsidin içindeki her özdes RNA molekülü 9 tane gen tasiyor. Bu genler: gag, pol, env, tat, rev, nef, vif, vpr, vpu dur.
Yapisal proteinlerden sorumlu genler; env: gp160 adli bir proteini kodluyor. Bu protein viral enzimler tarafindan parçalanip gp120 ve gp41 olusturuluyor ve zarfin yapisinda kullaniliyor.
gag:kapsid proteinlerini kodlayan gen bölgesi.
pol:revers transkriptaz enzimini kodlayan gen bölgesi.
Düzenleyici genler; tat:transkripsiyon hizini arttiran bir proteini kodluyor.
rev:mRNA nin çekirdekten sitoplazmaya geçmesinden sorumlu olan bir proteini kodluyor.
nef:tarafindan kodlanan proteinler virüsün verimli olarak replike olmasini sagliyor.
Yardimci genler; vpu, vfr ve vpr dir. vpu: tarafindan kodlanan genler virüs partiküllerinin enfekte edilmis hücreden saliniminda etkili.
LTR (long term repeat) denen ve RNA ipliklerinin sonunda bulunan kisimlar virüs çogalmasinda salterler gibi isliyorlar. Bu salterler HIV den veya konakçidan gelen proteinlerle açilabilir.
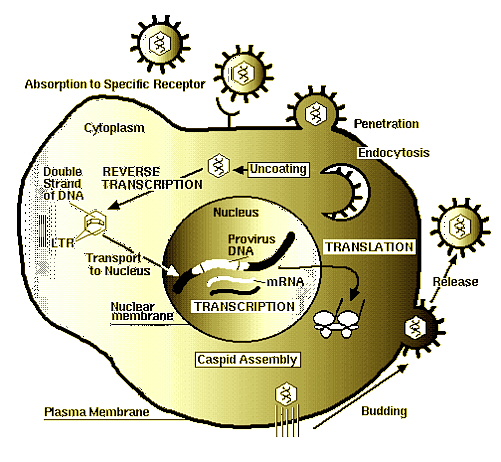
HIV’NIN YASAM DÖNGÜSÜ
Enfeksiyon bir HIV partikülünün , CD4 (cluster designation=küme ismi) diye bilinen bir yüzey molekülü tasiyan hücreye tutunmasiyla basliyor. Bu hücrelere CD4+(CD4 pozitif) hücreler deniliyor. Tutunma gp120 molekülleriyle CD4ler arasinda gerçeklesiyor. Tutunmayi füzyon izliyor. HIV1 deki füzyon kofaktörü gp41 dir. Füzyondan sonra konakçi hücre içinde serbest kaliyor. HIV’nin asil hedefi CD4+T(yardimci T hücreleri) gibi görünüyor fakat immün sistemin üzerinde CD4 içeren diger hücreleri de enfekte olabiliyor. Ayrica sinir sistemindeki hücreler galactosyl ceramide denilen yüzey reseptörü vasitasiyla enfekte edilebiliyorlar. Sitoplazmada revers transkriptaz enzimiyle virüsün RNA’si DNA’ya çevrilir. Bu sirada revers transkriptaz birçok hata yapabilir ve degisik varyasyonlar olusturabilir. Bu HIV varyasyonlarindan bazilari adeta organizma içi bir dogal seçilime ugrayarak hayatta kalabilirler. Antiretroviral tedavide kullanilan dideoksinükleazit analoglari revers transkripsiyon safhasini hedef alirlar. revers transkripsiyonu nükleusa transport ve viral DNA’nin hücre DNA’sina entegrasyonu izler. Entegrasyonda HIV’nin integraz enzimi görev alir. Daha sonra transkripsiyon meydana gelir. Immün cevapta kullanilan bazi sitokinezler, tumor necrosis factor (TNF)-alfa ve interleukin (IL)-6, provirüsün aktif hale gelip transkripsiyonun baslamasina neden olabiliyorlar. Bunun disinda Mycobacterium tuberculosis gibi organizmalarin olusturdugu enfeksiyonlar sonucunda transkripsiyon baslayabilir. Transkripsiyondan sonra mRNA nükleustan sitoplazmaya geçer ve translasyon meydana gelir. Sentezlenen RNA, yapisal proteinler ve enzimler birlestirildikten sonra hücrenin zar yapisini alan virüs disari çikar. virüs disariya çiktiginda hala olgun degildir dolayisiyla patojen de degildir. Proteaz adi verilen enzimlerle virüsün barindirdigi poliprotein zincirleri spesifik bölgelerden kirilir ve virüs olgunlasir. Proteaz inhibitörü denilen ilaçlar bu safhayi hedef almaktadir.
IMMÜN SISTEM KAS YAPAYIM DERKEN GÖZ ÇIKARTIYOR!
HIV transfüzyon yoluyla, genital yoldan, deri yoluyla (kontamine igne), plasenta yoluyla veya dogumdan sonra emzirme yoluyla vücuda girebilir. Bu virüs vücuda girmesiyle çok sayida CD4+ hücreyi enfekte ederler, kandaki CD+T hücre miktarinda azalmalar gözlenir. Akut dönemde muazzam bir sekilde artan virüs partikülleri özellikle lenfoid organlar(lenf dügümleri, dalak, bademcik, adenoitler) olmak üzere vücudun tüm organlarina yayilirlar. Virüs vücuda girdikten 2-4 hafta sonra hastalarin %70 inde nezle benzeri semptomlar ve karaciger büyümesi görülüyor(enfeksiyöz mononükleaz). 3 ay sonra CD8+T hücreleri (sitotoksik T hücreleri) ve plazma hücreleri tarafindan üretilen antikorlar yardimiyla kandaki HIV RNA miktari, yani virüs miktari azaltiliyor. Sonuçta hastanin CD4+T hücre miktari orijinal halinin %80-90 ina kadar ulasabilir. Kanda antikorlar üretildikten sonra hastada yillarca hiçbir semptom görülmeyebilir fakat hastaligin akut döneminde lenfoid organlarin germinal merkezlerinde bulunan folüküler dendiritik hücrelerde (FDC) hapsedilen virüsler devamli replike olurlar yani virüs kesinlikle latent bir enfeksiyona neden olmaz. B hücreleri ve CD4+T hücrelerinin immün cevabi olusturmak üzere germinal merkezlere gelmeleriyle büyük miktarda CD4+T hücresi enfekte olur. Kan dolasimina geçtiklerinde enfeksiyon diger CD4+T hücrelerine de bulasir. FDClere hapsedilmis HIV antikorlarla çevrili olmalarina ragmen patojenitelerini yitirmemislerdir. Germinal merkezlerin içinde ve etrafindaki B hücreleri tarafindan salgilanan TNF_alfa ve IL_6 gibi sitokinezlerin miktarinin artmasiyla CD4+T hücreleri aktive olurlar. Bu aktivasyonun sonucunda enfekte olmamis hücrelerin enfekte olmasi kolaylasir ve önceden enfekte olmus hücrelerdeki HIV replikasyonu hizlanir. TNF_alfa ve IL_6 saliniminin artmasi, diger sitokinezlerin saliniminin azalmasina neden olur. Mesela CD4+T hücrelerinden salinan IL_2 miktari azalir, bir de enfekte olmus hücrelerdeki IL_2 reseptörlerinin azalmasiyla bu enfekte olmus hücreler immün sistemin sinyallerine iyice tepkisiz hale gelirler. Yüksek miktardaki sitokinez saliniminin zararlari bu kadarla da kalmiyor, bunun yaninda yüksek seviyedeki TNF_alfa kismen kilo kaybina ve döküntü sendromlarina neden oluyor. Ayrica AIDS’e karsi olusturulan yogun antikor miktari yüzünden diger hastaliklara karsi üretilen antikor miktari azalir ve vücut birçok patojene karsi savunmasiz kalir. Hastaligin ileri safhalarinda asiri yüklenmeden dolayi FDC sebekeleri çöker ve birçok virüs kan dolasimina geçer. Sonuçta bazi firsatçi enfeksiyonlar ve AIDS’i karakterize eden kanserler (Karposis sarcoma ve lymphomas)olusur.
Monositler ve makrofajlar CD4 tasidiklarindan dolayi HIV ile enfekte olurlar fakat bu enfeksiyon litik degildir. Uzun süre yasayan bu hücreler virüsü özellikle akciger ve beyin olmak üzere birçok organa tasirlar. Böylece zatüre, nefes darligi ve sinir sisteminde anormallikler gözlenebilir. Ayrica sinir sistemi hücrelerinin tasidiklari galactosyl ceramide denilen yüzey reseptörleri vasitasiyla direkt enfekte edilebildiklerini daha önce belirmistim.
Enfeksiyonun akut döneminde CD8+T hücrelerinin immün cevaptaki rolü enfekte olmus hücreleri yok etmekle bitmiyor bunun yaninda CD8+T hücreleri bazi moleküller (RANTES, MIP1-alfa, MIP1-beta) salgilayarak HIV replikasyonunu bastirabiliyorlar. Bu moleküler hedef hücrelerdeki HIV reseptörlerine baglanarak HIV’nin hücreye adsorbsiyonunu engelliyorlar. Bazi kisilerin vücudunda bu moleküller asiri fazla miktarlarda bulunuyor, bu kisiler defalarca kere vücutlarina HIV almalarina ragmen AIDS’e yakalanmiyorlar. Söz konusu moleküller yapay olarak üretilebilinirlerse tedavi amaçli kullanilabilirler.
Eger birey HIV ile enfekte oldugunu düsünüyorsa, Eliza testi yaptirmadan önce en az 3 ay beklemelidir. Çünkü, daha önce de belirttigim gibi, HIV’ye karsi antikorlar üretimi ortalama olarak virüsün vücuda girisinden 3 ay sonra basliyor. Eliza testi pozitif sonuç verirse test tekrarlanmali ve daha sonra Blot testi uygulanarak teshis konulmalidir.
TEDAVI YÖNTEMLERI
Saglikli bir insanin kaninda 800-1200/mm3 CD4+T hücresi bulunur. AIDS hastasinda ise bu seviye 200/mm3’ün altina düser. AIDS’te de erken teshis ve tedavinin önemi büyüktür fakat kandaki CD4+T sayisi 500/mm3’ün üzerinde olan hastalarda antiretroviral tedaviye baslanmasi toksik etkiler, tolerans, maliyet, direnç gelisimi gibi nedenlerden dolayi sakincalidir. Daha etkili sonuçlar verdiginden dolayi antiretroviral tedavide kombine ilaç tedavisi kullanilir. Tedavide kullanilan ilaçlar temel olarak ikiye ayrilir. Bunlar: revers Transkriptaz baskilayicilari (dideoksi nükleazit analoglari, nonnükleazit inhibitörler) ve proteaz inhibitörleridir.
Dideoksi nükleozit analoglari:
AZT-Azidotimidin-Retrovir
ddI-Didanasine-Videx
ddc-Zalcitabin-Hivid
d4T-Stavudine-Zerif
3TC-iamivudine-Epivir
Ornek olusturmasi bakimindan AZT’den biraz bahsetmek istiyorum. AZT timin nükleosidinin (timidin) dideoksi nükleozit analogudur. AZT konak hücre içine girdikten sonra fosforile edilir ve virüsün revers transkriptazin aktivitesini engeller. DNA polimerazin, AZTtrifosfata revers transkriptazdan çok daha az duyarli olmasi tedavide avantaj saglar. Sadece oral formu mevcut olan AZT verilen hastalardaki firsatçi enfeksiyonlari önlemesinin yaninda HIV+ bireyin AIDS basamagina ulasmasini geciktirir. NIAID (National Instutute of Allergy and Infectious Diseases)’in sponsorlugunu yürüttügü arastirmalara göre AZT, HIV’nin anneden bebege geçme riskini 2/3 oraninda azaltiyor. Devamli kullanimda AZT’nin bulantidan baslayarak, kemik iligi toksisitesine varan genis spekturumlu toksisitesi mevcuttur. Ayrica, son zamanlarda AZT’ye dayanikli HIV suslari rapor edilmistir.
Nonnükleozit R.T. Inhibitörleri:
Nevirapine- Viramun
Delaviridine
Meydana getirdikleri yapi degisiklikleri ile R.T.’nin baskilanmasina neden olurlar. Bu ilaçlarin toksisitesi azdir, fakat virüsün direnç gelisimi çok hizlidir.
Proteaz Inhibitörleri:
Rionavir-Nervir
Indinavir-Crixivan
Saquinavir-Invirase: AZT ve ddC ile kullanildiginda CD4 sayisinda daha belirgin ve uzun sürteli artis gözlenir.
Proteaz enzimleri baskilanarak virüsün olgunlasmasi engellenir. Proteaz enzimleri virüse özgündür. Insan hücrelerinde bulunan proteazlardan farklidirlar. Proteaz inhibitörleri kalici enfeksiyon gelismis hücrelerdeki etkileri yönünden R.T. Inhibitörlerinden daha üstündür.
Günümüzde AIDS’e karsi uygulanan antiretroviral tedavi ile Pneumocysis carinii adli pnemöni engellenip hastanin yasam süresi uzatilabilmis fakat tamamen iyilesme saglanamamistir. Bu bakimdan virüsle enfekte olmamak için korunma yöntemleri titizlikle uygulanmalidir
belgesi-370
